Validação de HVAC e Controle Ambiental
Há sistemas de controle de HVAC manuais, semiautomáticos e totalmente automatizados. No geral, as empresas que utilizam os sistemas semiautomáticos possuem AHUs (Air Handling Unit), equipamentos que tratam o ar externo, porém o insuflamento do ar nas salas de produção tem vazão de ar fixa devido à ausência de automação das VAV’s (Variable Air Volume). As indústrias que utilizam o sistema totalmente automatizado instalam as VAV’s que modulam vazão de ar insufladas nas salas de produção. Estes sistemas de automação geralmente monitoram e registram as variáveis críticas do sistema de ar nas salas de produção, como temperatura, pressão diferencial e umidade relativa. Há muitas vantagens na utilização de sistema automatizado para o controle de HVAC, algumas delas valem a pena ser citadas:
– Economia de energia (costuma ser o maior “vilão” do consumo de energia das indústrias de Life Sciences);
– Controle preciso e muito mais apurado dos parâmetros críticos ambientais das salas de produção;
– Redução de mão de obra para operação da utilidade;
– Robustez e comprovação de boas práticas de fabricação;
– Facilidade de investigação de causa raiz de desvios e/ou não conformidades quando sistema registra as variáveis críticas das salas, incluindo audit trail de alteração de parâmetros críticos de alarmes e setpoints de controle;
Para suportar todos os regulados, a ANVISA elaborou o Guia de Validação de Sistemas Computadorizados e publicou em conjunto com a RDC 17/2010. O Guia foi baseado no GAMP5 – Guia Internacional publicado pelo ISPE – Good Automated Manufacturing Practice.
Guias e Normas
O Guia da ANVISA possui menções detalhadas que compõem praticamente os mesmos itens normativos constantes no FDA 21 CFR Part11. Alguns itens importantes desta norma são também claramente expressos na própria norma para indústrias farmacêuticas – a RDC 17/2010. Outras RDC’s emitidas posteriormente pela ANVISA após publicação do Guia de Validação de Sistemas tem as regras desta disciplina com escritas mais reduzidas, entretanto, o órgão regulador brasileiro emitiu o Guia a todos os regulados da agência. É um detalhe que faz toda a diferença, pois o Guia deixa claro que espera encontrar sistemas automatizados com alguns recursos tecnológicos que garantam, por exemplo:
– Controle de perfis (ou níveis) de acesso;
– Usuários personalizados com ID (identification) única;
– Trilha de auditoria para registro das modificações de parâmetros críticos (de qualquer dispositivo que tenham sido realizadas – IHM, supervisório);
– Registro íntegro dos parâmetros críticos (dados seguros, que não permitam violação ou manipulação);
– Assinatura eletrônica para alteração de parâmetros críticos, como setpoints de controle e alarmes das salas.
A decisão da instalação de um sistema automatizado para controle do HVAC de um site normalmente é uma decisão de negócio que prioriza a qualidade dos produtos que serão produzidos na planta. Uma vez tomada decisão no uso da automação, o sistema terá que ser validado. No Brasil, a norma mais conhecida que expressa tal necessidade é a RDC 17/2010 da ANVISA. Entretanto existem outros mercados regulados no Brasil. Clique na tabela a seguir:
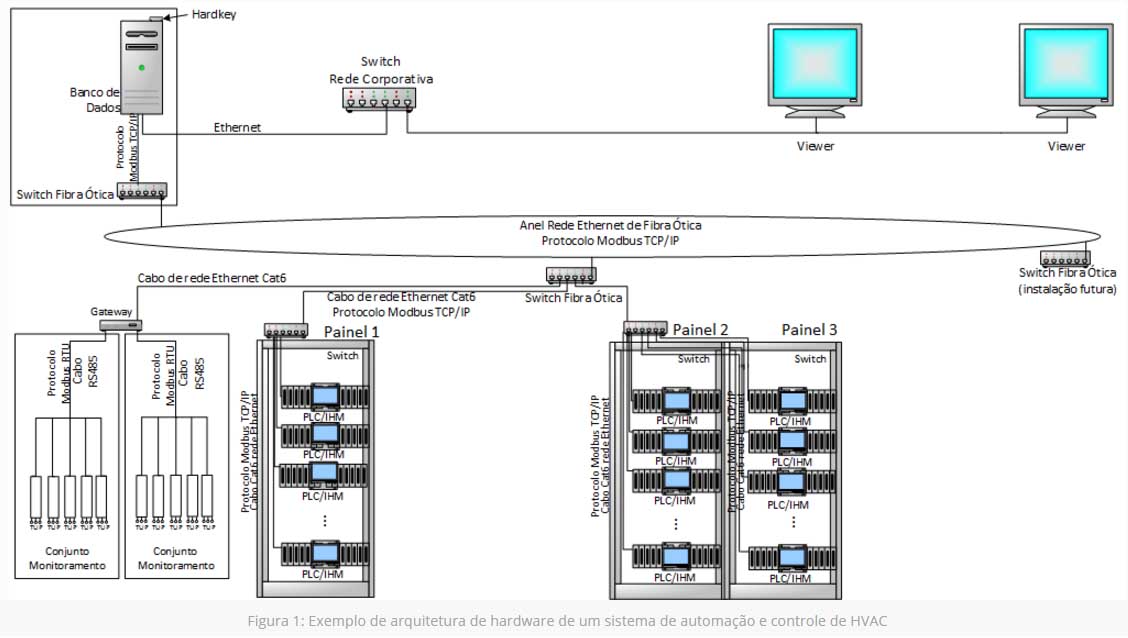
Um dos desafios de atendimento desta norma neste tipo de sistema é aplicar estas políticas de segurança em todos os componentes do sistema de controle, pois os sistemas de automação são formados por componentes de diferentes camadas (diferentemente dos softwares de gestão). Clique na imagem abaixo e veja os exemplos:
Perceba que a composição da arquitetura é formada por vários tipos de dispositivos, como: PLC, IHM, servidor e clients de supervisório ou viewers). O supervisório, como o próprio nome diz, é um software que ilustra o processo que está sendo controlado (neste caso automação de HVAC) e que possui interface com o PLC – equipamento que conecta os sensores do campo. É mais comum encontrar softwares supervisórios que atendem políticas de segurança como o Part11 e que viabilizam a validação, do que encontrar IHMs com tal atendimento.
A trilha de auditoria das ações críticas dos usuários do sistema deve ser executada de qualquer interface do sistema. Observe na arquitetura do sistema da figura 1 que alterações, aparentemente, podem ser realizadas através do supervisório e/ou IHM (Interface homem máquina).
As IHMs são dispositivos importantes utilizados neste tipo de sistema. No geral, elas são utilizadas para monitoramento e/ou controle local das máquinas de tratamento de ar (AHU). Também podem ser utilizadas como displays dos parâmetros críticos das salas de produção. A utilização destas interfaces pode ser uma decisão acertada, desde que tenham seus riscos analisados, principalmente com relação à aderência das normas e diretrizes de segurança da informação, preconizadas na RDC 17/2010, FDA 21 CFR Part11 e Guia de Validação de Sistemas Computadorizados.
Gerenciamento de Riscos
O Gerenciamento de Riscos é a estratégia principal prevista no GAMP5 que inclui análise dos riscos causados pelo sistema no processo que está controlando, incluindo potencial controle (ou mitigação), comprovação de implementação de tais controles e revisão dos riscos que continua pelo ciclo de vida do sistema até sua descontinuidade. Basicamente, este gerenciamento está associado às metodologias de análise de riscos visando definir, identificar e eliminar as possíveis falhas, problemas ou riscos potenciais que impactem na saúde do paciente, qualidade do produto e integridade de dados.
Neste tipo de sistema com arquitetura diversificada em termos de tipos de componentes, é importante levantar cenários de riscos como alguns exemplos:
– Sistema não registrar dados de trilha de auditoria dos usuários que alterem parâmetros críticos das salas através das IHMs locais;
– Sistema não identificar/registrar operador que altera dados críticos pelas IHMs locais;
– Velocidade do ventilador ser alterada indevidamente pela IHM do inversor de frequência através do display local do equipamento;
– Display local do inversor de frequência não registrar e/ou fazer interface com supervisório informando autor, data e hora de alteração de velocidade de ventilador;
– Faixa de atuação de ventilador ser limitada localmente pela IHM do inversor de frequência não permitindo sistema de controle atuar de forma devida no dispositivo.
Os exemplos de cenários de riscos anteriormente mencionados mostram que na prática, enfrentamos alguns desafios para a conformidade total da regulamentação neste tipo de sistema de controle, porém nos permite anteciparmos aos problemas que de fato ocorrerão na rotina, antes mesmo do sistema ter seu desenvolvimento finalizado, permitindo que a equipe multidisciplinar encontre formas mitigatórias factíveis para o projeto, como travas físicas nos dispositivos, travas eletrônicas nas IHMs, ou ainda, uso de IHMs em conformidade com FDA 21 CFR Part11. No dia a dia, percebemos que no geral, as alterações de parâmetros indevidas ocorrem por falta de comunicação entre as equipes de operação da produção, operação da utilidade e manutenção, portanto maior robustez na elaboração e treinamento de procedimentos no tratamento e registro das ações de modificações devem ser implementadas anteriormente à liberação do sistema de HVAC.
Monitoramento Ambiental
O monitoramento ambiental normalmente é composto por sensores de temperatura, umidade relativa e pressão diferencial das salas de produção. Este sistema pode fazer parte integrada do sistema de automação e controle do HVAC ou ser projetado para ser instalado de forma separada da automação.
Profissionais de alguns países utilizam abordagem de validação de sistemas computadorizados do sistema de monitoramento ambiental, sem necessidade de validação do sistema de controle e às vezes, a abordagem é aceita por órgãos reguladores. Entretanto, esta prática tem a cada dia sendo mais questionada porque no geral, se o sistema de controle não está validado, também não contempla conformidade com Part11, por exemplo. Portanto, no caso de desvio do parâmetro crítico, a investigação do desvio se torna prejudicada devido ao sistema de controle não indicar autor, data e hora de alteração do parâmetro de controle anterior ao comportamento indevido da variável crítica da sala. ANVISA tem recomendado e exigido das empresas inspecionadas que validem tanto o sistema de controle, quanto o sistema de monitoramento ambiental, sejam eles integrados ou separados.
Referências
GAMP5: Good Automated Manufacturing Practice: Guia de Validação de Sistemas Computadorizados publicado pelo ISPE em fevereiro de 2008.
FDA 21 CFR Part11: Resolução do FDA que estabelece políticas de segurança para implementação de registro eletrônico e assinatura eletrônica publicada em março de 1997.
RDC 17/2010: Resolução da Diretoria Colegiada n° 17 da Agência Nacional de Vigilância Sanitária que rege sobre Boas Práticas de Fabricação de Medicamentos de Uso Humano, publicada em 16/04/2010.
Guia da ANVISA: Guia para Validação de Sistemas Computadorizados publicado pela ANVISA em abril de 19/10/2010.
ANNEX 11 EMA:Eudralex – The Rules Governing Medicinal Products in the European Union – Volume 4 – Good Manufacturing Practice – Medicinal Products for Human and Veterinary Use – Annex 11: Computerized Systems.