Gerenciamento de Riscos na indústria farmacêutica
Em uma série de artigos que se inicia hoje, Jair Calixto, gerente de Boas Práticas e Auditorias Farmacêuticas do SINDUSFARMA, fala sobre a adoção de mecanismos de análise de risco em processos farmacêuticos.
Em determinados eventos em que tenho participado, muito se tem falado sobre Análise de Riscos. Diversas são as áreas no universo dos medicamentos onde o assunto tem sido debatido. O tema tem sido tratado de forma muito mais corriqueira do que imaginamos. Alguns poderiam esperar uma abordagem voltada apenas ao campo da sugestão, teoria ou experimentação. Porém, não é isto que ocorre. Percebe-se que a adoção de mecanismos de análise de risco em processos farmacêuticos é usual e rotineira, em vários países.
Faz sentido. Tenho visto que as Agências Reguladoras não têm e nunca terão estrutura para atender às demandas existentes relativas à inspeção e certificação, sejam elas em medicamentos, insumos ativos, produtos para a saúde ou cosméticos, entre outros produtos.
A razão é simples: a complexidade logística e de negócios, ocorrida a partir dos anos 1990, tornou a administração e o controle dos medicamentos muito mais difícil, pois se observa, cada vez mais, uma maior circulação de produtos com maior rapidez entre os países. Partes de processos estão sendo executadas em mais de um país e concluídos em um terceiro, produtos estão sendo comercializados em embalagem primária, em “bulk”, em intermediários, para serem concluídos no país de destino.
Esta extrema complexidade tem onerado as Agências Reguladoras, que se encontram em um paradigma: como fazer cumprir o rito sanitário necessário e manter a segurança do paciente, sem interferir e bloquear as operações comerciais entre os diferentes atores?
A demanda crescente se opõe à falta de recursos e estrutura das agências. Cada vez mais. Deste modo, para fazer frente a esta demanda e atender com segurança os requerimentos sanitários, órgãos reguladores de diversos países têm lançado mão de alternativas que minimizem estas dificuldades, garantindo a qualidade dos produtos e serviços. Uma delas é a Análise de Riscos.
O que é a Análise de Riscos?
Todos os eventos da vida, frequentemente, possuem algum tipo de risco envolvido, seja maior ou menor, mas sempre existirá uma probabilidade de potencial ocorrência. Toda ação planejada, pode ou não, levar a um ganho ou a uma perda. Não é diferente nas empresas, onde o risco pode ser maior menor, dependendo do tipo de negócio envolvido, e tem que ser identificado, avaliado e controlado. Decisão com informações insuficientes pode levar a um Risco.
Neste contexto, a análise de riscos é uma ferramenta que auxilia as empresas na tomada de decisão sobre determinação de riscos em seus processos internos e externos e auxilia na implantação do gerenciamento de riscos na qualidade (GRQ).
Uma abordagem efetiva do GRQ pode garantir elevada qualidade do medicamento para o paciente.
O uso do GRQ na indústria farmacêutica tornou a tarefa mais científica com a publicação do guia ICH-Q9, permitindo a avaliação do risco em todas as etapas e atividades de fabricação. O uso destas ferramentas não exclui a adoção e uso de outros requisitos de controle.
Histórico
Com o resumido histórico a seguir, podemos notar que a avaliação de riscos não é assunto recente, mas já a partir da década de 40 teve inicio na área militar.
1949: Avaliação confiabilidade equipamentos militares (Military Procedure MIL-P-1629).
1958/1959: NASA – Cia. Pillsbury (Sistema de gestão de segurança alimentar); Este método foi desenvolvido pela NASA para prevenir a contaminação no alimento dos astronautas.
Modelos foram aperfeiçoados ao longo dos anos, gerando ferramentas de elevado grau de eficiência.
1971: HACCP 1ª versão disponibilizada e adotada pela indústria de alimentos.
1985: “HACCP” adotada pela FAO e OMS.
1999: ISO/IEC guia 51 Aspectos de Segurança.
2000: ISO14971 Risco em produtos médicos.
2002: ISO/IEC guia 73 – Gestão de riscos.
2003: OMS TR 908, anexo 7, HACCP para medicamentos.
2005: ISO 22000 – Sistema de Gestão de Segurança Alimentar baseada nos princípios do HACCP do Codex Alimentarius, com enfoque na segurança alimentar em todas as etapas da cadeia de fornecimento.
2006: ICH Q9 – Gerenciamento de riscos.
Normas internacionais de referência
As principais normas utilizadas para avaliar o risco na indústria farmacêutica são dadas a seguir. Mais a frente forneceremos informações complementares sobre o GRQ da ICH Q9 e o Anexo 7 da OMS – Organização Mundial da Saúde (WHO).
ICH Q9 – Guidance for Industry – Quality Risk Management. WHO – Technical Report Series nº 908, 2003 Annex 7 – Application of Hazard Analysis and Critical Control Point (HACCP) methodology to pharmaceuticals ISPE – GAMP 5.
Definições
Para entender os critérios e conceitos sobre análise de risco é preciso conhecer as definições principais.
Análise de risco – estimativa do risco associado com os perigos identificados. É o processo qualitativo ou quantitativo que estabelece uma ligação entre a ocorrência e a severidade dos danos. ICH Q9 Ponto crítico de controle PCC / CCP (critical control point) Um passo onde o controle pode ser aplicado e é essencial para prevenir ou eliminar o risco da qualidade farmacêutica ou reduzi-la a níveis aceitáveis. Risco – Combinação da probabilidade de ocorrência de um dano e sua severidade (ICH Q9). Dano – Prejuízo à saúde em decorrência da ausência ou perda de qualidade do medicamento. Perigo – Fonte potencial de dano (ISO/IEC guia 51). Qualquer situação na produção, controle e/ou distribuição de medicamentos capaz de causar um efeito adverso para a saúde ou desvio de qualidade. Ref.: WHO TRS No. 908, 2003 – Annex 7 e ICH Q9, Nov 2005.
Conceitos básicos sobre riscos
Severidade – Mede impacto causado, seja para pacientes, para a empresa ou para a comunidade. Pode admitir três graduações ou mais. Abaixo apresentamos uma divisão em três escalas. Assim a severidade pode ser: I – Catastrófica: Alto custo ou perda. Afeta de maneira significativa a organização: missão, reputação e interesses. Risco de saúde grave ou morte. II – Crítica: Perda ou custo moderado. Afeta moderadamente a organização. Pode causar danos moderados às pessoas. III – Marginal: Custo ou perda baixo. Baixo impacto sobre a organização.
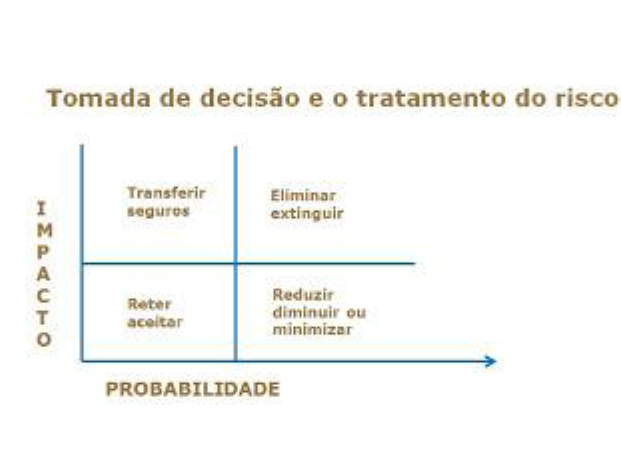
Considerando risco de maneira genérica, em todos os campos de atividades, o impacto tem relação com a probabilidade. Assim, temos quatro resultados possíveis para o dimensionamento do risco e seu tratamento:
Transferir- contratos com terceiros (resíduos, análises, etapas de produção).
Eliminar – adotar uma medida (HVAC, validação, reforma, procedimentos).
Aceitar – monitoramento temperatura, contrato de transporte.
Minimizar – medidas para reduzir impactos e reduzir probabilidade de ocorrência.
Risco: Causa x Efeito
Todo risco tem sempre atrelado a ele uma causa e um efeito. É isto que tem que ser analisado e entendido para sua resolução: descobrir a causa para combater seu efeito. Esta relação entre risco x causa x efeito é explicada no gráfico abaixo.
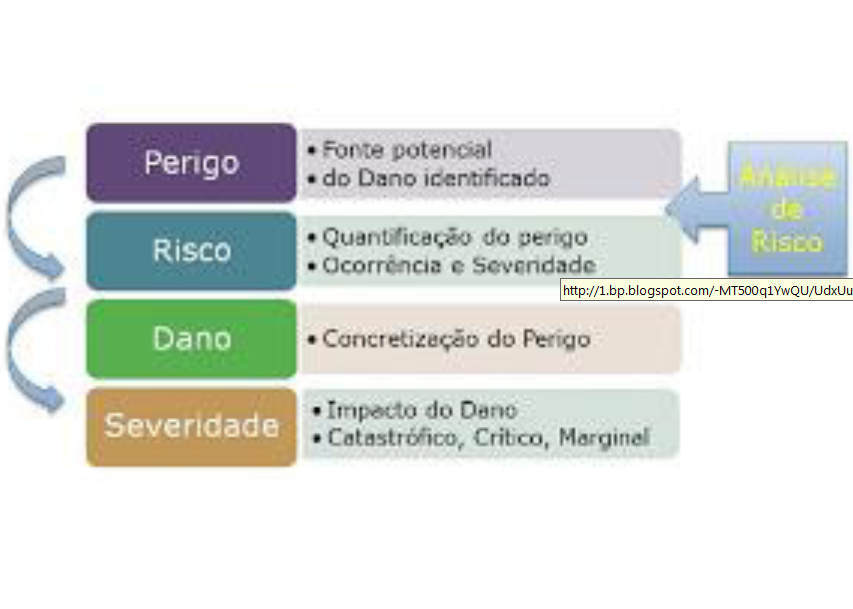
Relação entre risco, perigo e dano
Podemos estabelecer uma relação entre Risco, Perigo e Dano. O PERIGO é a fonte potencial do dano identificado. O RISCO é a quantificação do Perigo, ligado à Ocorrência e à Severidade. O DANO é a concretização do Perigo. A SEVERIDADE, como já visto, é o impacto causado pelo Dano.
Assim, com a determinação da(s) causa(s) e do(s) efeito(s) através do uso da análise de riscos, podemos responder à pergunta “O que se espera da Análise de Riscos?”
Na semana que vem, a segunda parte deste artigo falará sobre as FERRAMENTAS DE ANÁLISE DE RISCOS e a Graduação FMEA – Análise de Modo e Efeito de Falhas.
Jair Calixto – Gerente de Boas Práticas e Auditorias Farmacêuticas do SINDUSFARMA (Sindicato da Indústria de Produtos Farmacêuticos no Estado de São Paulo).





Assunto bastante útil. Matéria esclarecedora. Aguardo segunda parte.
Muito bom o artigo…gostei muito!!!
Parabéns pela explanaçao, prof. jair Calixto. Simples, prática e contextualizada; além de envolver elementos de sua experiência e vivência na área. A Sindusfarma segue sendo grande parceira em defesa da saúde com influenciadores como você!