A implantação das BPLM como forma de reduzir erros analíticos e riscos ligados à prática laboratorial
Os medicamentos, alimentos, produtos destinados para a higiene pessoal e embelezamento, e outros produtos considerados críticos para a saúde requerem aprovação do controle de qualidade microbiológico para a posterior liberação ao mercado. No mesmo sentido, as áreas industriais consideradas críticas e semicríticas para a qualidade dos produtos genericamente relacionados acima, ou para suas matérias-primas e insumos de produção, requerem controle e acompanhamento através do monitoramento microbiológico ambiental.
Segundo a Resolução da Anvisa, RDC 17/2010, no seu Artigo 281, o Controle de Qualidade é responsável pelas atividades referentes à amostragem, às especificações e aos ensaios, bem como à organização, à documentação e aos procedimentos de liberação que garantam que os ensaios sejam executados, e que os materiais e os produtos terminados não sejam aprovados até que a sua qualidade tenha sido julgada satisfatória.
A diversidade de situações onde o controle microbiológico é requerido proporciona uma enorme quantidade de variáveis, que podem afetar direta ou indiretamente as respostas analíticas, e, sobretudo produzir risco sanitário interno e/ou externo as organizações. A rotina da microbiologia analítica faz uso de cepas puras de microrganismos para o controle de qualidade dos meios de cultura e para a validação dos métodos analíticos, além de outros usos indicados. Ainda, a proliferação da microbiota nativa, através dos ensaios de monitoramento ambiental ou de controle dos produtos, potencializa a carga contaminante existente. O objetivo deste artigo é salientar a importância da implantação das Boas Práticas de Laboratório de Microbiologia como uma forma eficiente para diminuir os riscos e as falhas na rotina analítica.
Objetivos das BPLM
As Boas Práticas de Laboratório de Microbiologia tem como principal objetivo prover um sistema de qualidade tal, que minimize ao máximo os desvios e falhas que refletem diretamente em resultados falso-positivos ou falso-negativos, proporcionando ainda, a proteção da amostra, e os meios para analisála com segurança, além da redução de riscos para o ambiente e para o analista, bem como garantir rastreabilidade do processo analítico como um todo.
Pontos essenciais das BPLM
O tema “Boas Práticas de Laboratório – BPL” foi amplamente difundido no Brasil através da norma ISO 17025:1999 e pelo guia da Anvisa de 2002 dentro da política de acreditação de laboratórios analíticos. No ano de 2006, esta Agência publicou uma tradução do guia europeu EURACHEM EA 04/10, com o título – Habilitação para Laboratórios de Microbiologia, objetivando a implantação de um sistema rastreável nas práticas analíticas, além de promover as BPL de microbiologia.
A Farmacopéia Americana, no capítulo 1117, também apresenta as bases para a implantação das BPL para Microbiologia. No mesmo rumo, a Organização Mundial da Saúde, publicou neste ano o TRS 957, que contém no seu Anexo 1, as Boas Práticas para laboratórios de controle de qualidade farmacêuticos. Este documento indica que em breve será publicado um complemento que tratará especificamente das BPL para microbiologia.
Os principais pontos abordados pelas bibliografias consultados acerca das BPLM são os seguintes: ambiente e infra-estrutura do laboratório; qualificação pessoal; qualificação, calibração e manutenção preventiva de equipamentos; preparo e controle de qualidade dos meios de cultura e reativos; preparo e manutenção dos materiais usados na prática analítica; manipulação e manutenção dos estoques dos microrganismos de referência; prazos de validade para meios prontos ou preparados no laboratório, cepas de trabalho e materiais reciclados; técnicas assépticas de amostragem, preparo das amostras e sua utilização nos ensaios; validação dos ensaios analíticos aplicados no controle de qualidade de produtos e materiais; cuidados e riscos associados aos processos para a reciclagem de materiais não-descartáveis; implantação de um sistema de qualidade documentado, dentre outros.
A análise de tendências das exigências sanitárias no Brasil permite afirmar, que cada vez mais frequentemente serão exigidos das empresas a demonstração prática dos meios necessários para a redução de falhas e riscos nas práticas laboratoriais microbiológicas. Isto é devido ao risco real de aprovação de produtos fora das especificações, ou da contaminação do ambiente laboratorial, industrial e/ou externos a empresa.
Podemos citar o exemplo dos produtos injetáveis e/ou aqueles de uso hospitalar. A falha no ensaio de controle microbiológico nestes produtos poderá gerar grandes danos a saúde do usuário. Porém, não estão livres deste tipo de risco, aqueles produtos destinados a higiene ou estética corporal, alimentos e águas, medicamentos de forma geral, e outros que devem passar pelos ensaios de controle microbiológico. Além disto, a contaminação do ambiente laboratorial é o caminho inicial para a contaminação das linhas de produção de uma indústria. As limitações peculiares às metodologias de controle de qualidade microbiológico, associadas à diversidade de microrganismos presentes em áreas, matérias-primas, produtos, materiais de embalagem, pessoal, ar, etc., e a falta de BPLM gera um espaço de incertezas que provoca uma grande fragilidade nas organizações.
A redução do índice de falhas, bem como a proteção dos analistas e dos ambientes, está intimamente ligada à estruturação racional da área física do laboratório, contendo um fluxo operacional sem cruzamentos críticos, associado a um sistema de insuflamento de ar filtrado e exaustão, onde seja impedida a contaminação cruzada e as possíveis contaminações via fluxo de ar. A separação de espaços para as diversas atividades de rotina, como: recepção de amostras, preparação dos materiais, preparação das amostras, inoculação, incubação, estoque de materiais e insumos, área para descontaminação e esterilização, dentre outras necessárias.
Além da qualificação profissional inicial, e a freqüência dos treinamentos dos analistas e demais colaboradores, são ações práticas fundamentais para a implantação e manutenção das BPLM.
Análise de riscos e pontos críticos nos ensaios microbiológicos de controle de qualidade
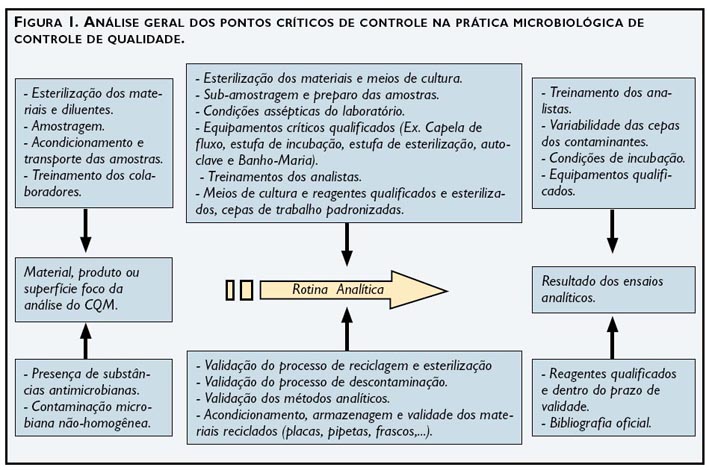
A análise dos pontos críticos que requerem controle, qualificação ou validação no fluxo analítico proporciona um entendimento real da necessidade de implementação das BPLM, incluindo as validações de limpeza das vidrarias e materiais, dos processos de descontaminação e esterilização, além da validação dos métodos microbiológicos utilizados, sendo estes farmacopeicos ou não. A Figura 1 apresenta os principais pontos críticos que requerem algum tipo de controle na rotina analítica microbiológica.
Redução de riscos na prática laboratorial
A segurança pessoal obtida através de recursos tecnológicos, associada à alta qualificação dos profissionais da área analítica, além de procedimentos operacionais padronizados, garante a redução dos acidentes e de riscos para os analistas e colaboradores do laboratório. Os recursos tecnológicos mínimos necessários para a biossegurança são: equipamentos de proteção Individual capazes de proteger inteiramente o analista do produto, dos microrganismos manipulados, e estes do analista/colaborador do laboratório; equipamento lava-olhos; capela de fluxo unidirecional vertical grau A ou B para contenção de risco biológico; capela de fluxo unidirecional horizontal para prova de esterilidade, quando requeridas; autoclaves e/ou estufas para a esterilização e descontaminação; capela de exaustão para manipulação de substâncias voláteis e/ou tóxicas; estufas para incubação com capacidade comprovada de manutenção das temperaturas na faixa de trabalho; além de outros equipamentos e materiais, conforme as operações específicas realizadas em cada laboratório.
Em somatório a estes recursos, o laboratório deve possuir um Sistema de Garantia da Qualidade (SGQ) que contemple a legislação e normas vigentes, e inclua procedimentos operacionais padrão específicos para a prevenção da contaminação local, e que abranja pelo menos as seguintes atividades: limpeza e sanitização das áreas do laboratório de controle; contenção da contaminação microbiana por quebra de frascos ou derrame de suspensões contendo cepas patogênicas, ou acidentes gerais; limpeza e sanitização/ descontaminação dos equipamentos e utensílios; procedimento de monitoramento ambiental abrangente ao pessoal, equipamentos, ar e superfícies do laboratório, e que vincule os resultados a um plano estratégico de sanitização e/ ou descontaminação local; plano de investigação de não-conformidades ou de tendências assumidas nos resultados de controle; procedimento para o controle de mudanças em procedimentos, métodos e controles das operações críticas à abrangência do laboratório; manutenção preventiva e verificação de funcionalidade com alta freqüência para os equipamentos críticos; descarte de materiais e resíduos após os ensaios microbiológicos.
Ainda, as BPLM exigem os estudos de validação dos sistemas e processo críticos do laboratório, além das metodologias analíticas. Estes estudos devem seguir as normas específicas para a execução das validações e qualificações. A manutenção e o aperfeiçoamento das boas práticas implantadas são possíveis de se obter na rotina, com um programa de auto-inspeções frequentes no laboratório. Esta é uma poderosa ferramenta de verificação dos pontos vulneráveis na ótica das BPLM. E desta, origina o plano de adequações e melhorias que é a base para as ações concretas e imprescindíveis na dinâmica deste segmento.
Bibliografia recomendada
– AGALLOCO, J., Carleton, F. J. Validation of Pharmaceutical Processes. Informa
Healthcare. 3 ed. New York, 2008.
– AMARAL, F. D. Controle da contaminação microbiana em ambiente industrial farmacêutico – Como atingir as metas? Controle de Contaminação, Ano 6, No. 57,
32-37, Janeiro 2004.
– AMARAL, F. D. Controle microbiano em produtos farmacêuticos – Como obter credibilidade nos resultados analíticos? Controle de Contaminação, Ano 6, No. 61, 30-33, Maio 2004.
– AMARAL, F. D. Validação de limpeza. Controle de Contaminação, Ano 9, No. 96, 27-29, Junho, 2007.
– AMARAL, F. D. Validação de Métodos Analíticos Microbiológicos através da prova de recuperação do inoculo. Controle de Contaminação, No. 124, 23-26, Agosto de 2009.
– BRASIL. Ministério da Saúde. Anvisa. Guia para a habilitação de laboratórios analíticos em saúde segundo a norma ISO/IEC 17025. Brasília, 2002.
– BRASIL. Ministério da Saúde. Anvisa. Habilitação de Laboratórios de Microbiologia. Séries Temáticas. Vol. 3. Brasília, 2006.
– BRASIL. Ministério da Saúde. Resolução Anvisa – RDC n°17, de 16 de abril de 2010. Regulamento de Boas Práticas de Fabricação para Medicamentos. Brasília: ANVISA, 2010.
– ISO, International Standard 14.698-2. Cleanrooms and associated controlled environments – Part 2: Evaluation and interpretation of biocontamination data, 2003.
– WHO. Technical Report Series, Nº 957. Good Pratices for National Pharmaceutical Control Laboratories: Geneva, 2010, Annex 2.
– THE United States Pharmacopeia. 32 ed. Rockville, Mack Printing, 2009.
Fernando D. Amaral – Farmacêutico Industrial, Mestre em Microbiologia, Consultor Técnico.
fdamaral@terra.com.br
Publicado originalmente na Revista Controle de Contaminação.