Análise de Riscos e Pontos Críticos de Controle – APPCC
Nesta semana, o gerente de Boas Práticas e Auditorias Farmacêuticas do SINDUSFARMA, Jair Calixto, encerra a série de artigos sobre Gerenciamento de Riscos na indústria farmacêutica falando sobre o APPCC ou HACCP. Leia também o capítulo 1 e o capítulo 2.
O HACCP – Hazard Analysis Critical Control Points ou Análise de Perigos e Pontos Críticos de Controle é uma ferramenta sistemática, pró ativa e preventiva, para assegurar a qualidade, confiança e segurança de um produto (vide WHO Technical Report Series No. 908, 2003, Annex 7). É uma abordagem estruturada que aplica princípios técnicos e científicos para analisar, avaliar, prevenir e controlar o risco ou consequências adversas devido ao projeto, desenvolvimento, produção e utilização dos produtos.
Basicamente divide-se em duas partes: 5 Passos e os 7 Princípios.
Os 5 passos do HACCP
1. Formar a equipe HACCP
2. Descrever o produto e processo
3. Identificar o uso intencional
4. Elaborar o diagrama de fluxo
5. Confirmar o diagrama de fluxo no local
Destaque-se que a formação multidisciplinar da equipe e a elaboração do diagrama de fluxo são os dois itens mais importantes para a identificação do risco. A equipe multidisciplinar tem a capacidade de avaliar o processo em toda a sua amplitude e profundidade e o diagrama do fluxo identifica corretamente o processo a ser estudado. Não é possível aplicar ferramenta de análise de riscos onde não se conhece detalhadamente o processo.
Os 7 Princípios do HACCP
1. Realizar análise de risco.
2. Determinar / Estabelecer os pontos críticos de controle (PCCs / CCPs).
3. Estabelecer os limites centrais e o(s) limite(s) crítico(s).
4. Criar um sistema para monitorar os PCCs.
5. Medidas / Ações corretivas.
6. Criar procedimento de verificação.
7. Criar procedimentos para registro de dados.
O principal elemento destes 7 Princípios é o estabelecimento dos pontos críticos de controle (PCCs). Os PCCs são as entradas do sistema (locais) onde o risco tem maior probabilidade de aparecer e causar impacto, conforme sua graduação estabelecida através do método de pontuação SxOxD. Além da determinação dos PCCS e sua pontuação, o estabelecimentos dos seus limites e a forma de monitoramento complementam o núcleo central destes princípios.
Gerenciamento de Riscos
O gerenciamento de riscos é mais amplo que a análise de riscos. Envolve um mecanismo de contínua avaliação do processo, daí o uso do gerenciamento, onde a análise do risco é apenas um elemento. Surge outra pergunta: por que Gerenciar Riscos? Podemos afirmar que é para poder garantir:
# Qualidade /Segurança / Eficácia dos medicamentos.
# Redução do Risco Sanitário.
# Saúde dos Pacientes.
# Saúde e Segurança dos colaboradores e comunidade.
# Prevenção de impactos ao Meio Ambiente.
# Atendimento às Leis (COMPLIANCE).
# A proteção à imagem e ao patrimônio da empresa.
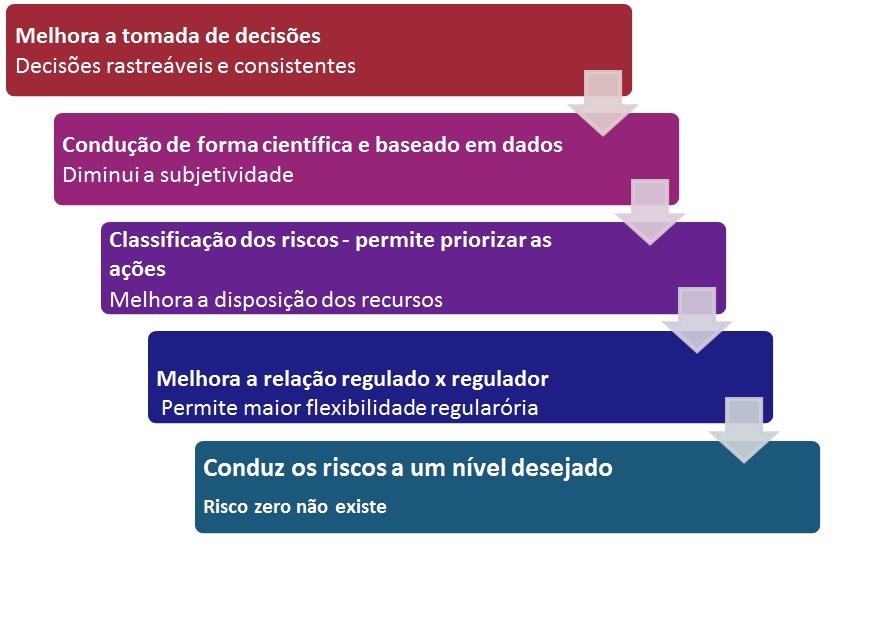
Como informação acessória e complementar, podemos também elencar também “Os Objetivos do Gerenciamento de Riscos dentro do Sistema de Qualidade”. Eles não se limitam à lista abaixo.
Podemos, a partir dos Objetivos, identificar os reais Benefícios do Gerenciamento de Riscos para a empresa como um todo.
Quais são eles?
As diversas fases do gerenciamento de riscos
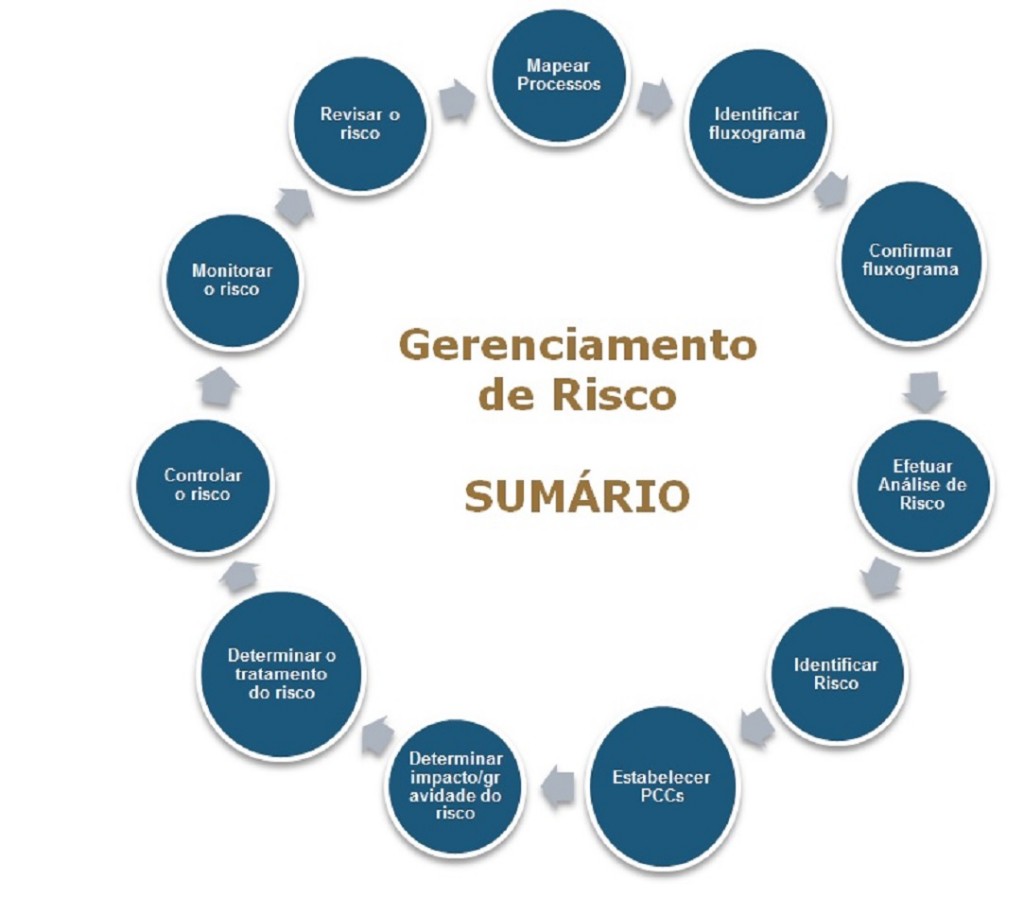
O processo de Gerenciamento de Riscos, conforme falado antes, não se restringe apenas à Análise de Riscos. A sequência completa é dada a seguir.
Definição: Processo sistemático de avaliação, controle, comunicação e revisão dos riscos da qualidade dos produtos dentro do seu ciclo de vida.
Resultado da revisão periódica de produtos, das inspeções, das auditorias, do controle de mudanças, das investigações de desvios, recolhimentos, reprovações, devoluções.
Por fim, o processo completo do gerenciamento de riscos, resumido abaixo, mostra que o ciclo é contínuo, pois a administração do risco não é interrompida nunca, sob pena de aparecimento de outros novos riscos potenciais, quando o processo de mudanças não é devidamente monitorado. A seguir minha interpretação para este ciclo contínuo do gerenciamento.
Conclusões
As ferramentas de análise de risco podem auxiliar os reguladores e as empresas a identificar os riscos durante as auditorias realizadas, com aplicação direcionada de suas estratégias, focando seus recursos essenciais nos elementos – produtos, empresas, processos, serviços – de maior risco para o paciente. Podemos considerar o seguinte:
– Uso da HACCP não exclui uso das Boas Práticas de Fabricação (BPFs);
– Operação deve estar conforme as BPFs;
– Exigência regulatória atualmente;
– É uma prática mundial;
– Possibilita maior conhecimento do processo;
– Aumenta o nível de qualidade;
– É ferramenta para Melhoria Contínua;
– São necessários novos conhecimentos e habilidades (trabalho em equipe, outros departamentos);
– Auxilia no “Compliance” regulatório;
– Exige equipe da área de Qualidade para implantar métodos de Análise de Risco.
Referências
Zardo, H. – Workshop Sindusfarma – Q8, Q9, Q10, novembro 2008. Botet Fregola, J., 2009. “GMPs del siglo XXI”. Un arma contra la crisis. Indúustria Farmacéutica, 147, 97-102. Botet Fregola, J, Sistema de Calidad Farmacéutica Del Siglo XXI – Jordi Botet – Editora RCN – 2008. Hulbert, Matthew H. at all – Risk Management in the Pharmaceutical product Development Product J. Pharm. Innov. (2008) 3:227-248 ICH Q8 – Pharmaceutical Development ICH Q8 R(2) – Pharmaceutical Development Revision 2 ICH Q9 – Quality Risk Management ICH Q 10 – Pharmaceutical Quality System MORETTO, L.D.; CALIXTO, J. Estrutura do Novo Sistema de Qualidade para a Indústria Farmacêutica. São Paulo; SINDUSFARMA, volume 5, 114 pp., 2009. MORETTO, L.D.; CALIXTO, J. Diretrizes para Gerenciamento de Riscos nos Processos da Indústria Farmacêutica . São Paulo. SINDUSFARMA, volume 13, 188 pp., 2011. MORETTO, L.D.; CALIXTO, J. Guia de autoinspeção na indústria farmacêutica. São Paulo. SINDUSFARMA, volume 8.1, 2010.
Jair Calixto – Gerente de Boas Práticas e Auditorias Farmacêuticas do SINDUSFARMA (Sindicato da Indústria de Produtos Farmacêuticos no Estado de São Paulo).