Data Integrity na indústria farmacêutica
Motivadas por um aumento do número de não-conformidades na Indústria Farmacêutica, as agências reguladoras, FDA , MHRA , OMS e PIC/S emitiram nos últimos anos orientações de como proceder para manter íntegros dados críticos relacionados à produção de seus produtos.
A maior parte desses Guias de Integridade de Dados está na versão Draft, para receber contribuições e posteriormente seguirem para a versão final. Não apresentam novas diretrizes a serem seguidas, mas deixam claro que os órgãos reguladores estão mais atentos a questão da Integridade de Dados e a Indústria deve dar atenção especial para o tema e evitar não-conformidades que acarretam uma série de sanções.
Dados que devem ter sua integridade preservada
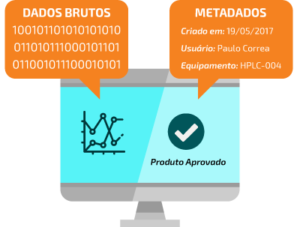
Todos os dados finais referentes ao processo produtivo, os Metadados, que carregam informações sobre o dado principal e Raw Data devem fazer parte do processo de garantia de integridade.
 A primeira ação que deve ser considerada na busca pela Integridade dos Dados é registrar a situação atual da empresa, com uma análise da observância das normas na administração de dados críticos.
A primeira ação que deve ser considerada na busca pela Integridade dos Dados é registrar a situação atual da empresa, com uma análise da observância das normas na administração de dados críticos.
Posteriormente, um trabalho em conjunto da equipe de validação e de garantia da qualidade na elaboração de uma análise de riscos é necessário para que sejam definidos quais dados têm relação com as Boas Práticas e com a liberação dos lotes de medicamentos.
A especificação dos dados que devem entrar nesse processo visa evitar que todos os dados da empresa, mesmo os que não estão sujeitos às normas, sejam incluídos no processo de Garantia de Integridade, pois isso elevaria os custos e a burocratização do processo produtivo e liberação dos resultados das análises no Controle da Qualidade.
De acordo com o Guia GAMP 5 e Guia de Validação da ANVISA, Dados Brutos são todos os dados nos quais as decisões de qualidade são baseadas.
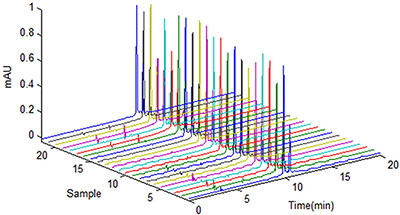 Exemplos de Raw Data (dados brutos) – Fotografias que acompanham reclamações de produtos, registros de monitoramento ambiental e calibração e qualificação de equipamentos, registros de limpeza e manutenção de equipamento, registros de produção de lote, transcrições manuais de displays e equipamentos, cromatogramasde HPLC , registros de inventário, registro de treinamentos.
Exemplos de Raw Data (dados brutos) – Fotografias que acompanham reclamações de produtos, registros de monitoramento ambiental e calibração e qualificação de equipamentos, registros de limpeza e manutenção de equipamento, registros de produção de lote, transcrições manuais de displays e equipamentos, cromatogramasde HPLC , registros de inventário, registro de treinamentos.
Planos mestres e procedimentos devem considerar estas informações, para que o Sistema de Qualidade tenha definido claramente quais os dados serão submetidos às Boas Práticas de Data Integrity.
Características de um dado íntegro – Data Integrity – FDA
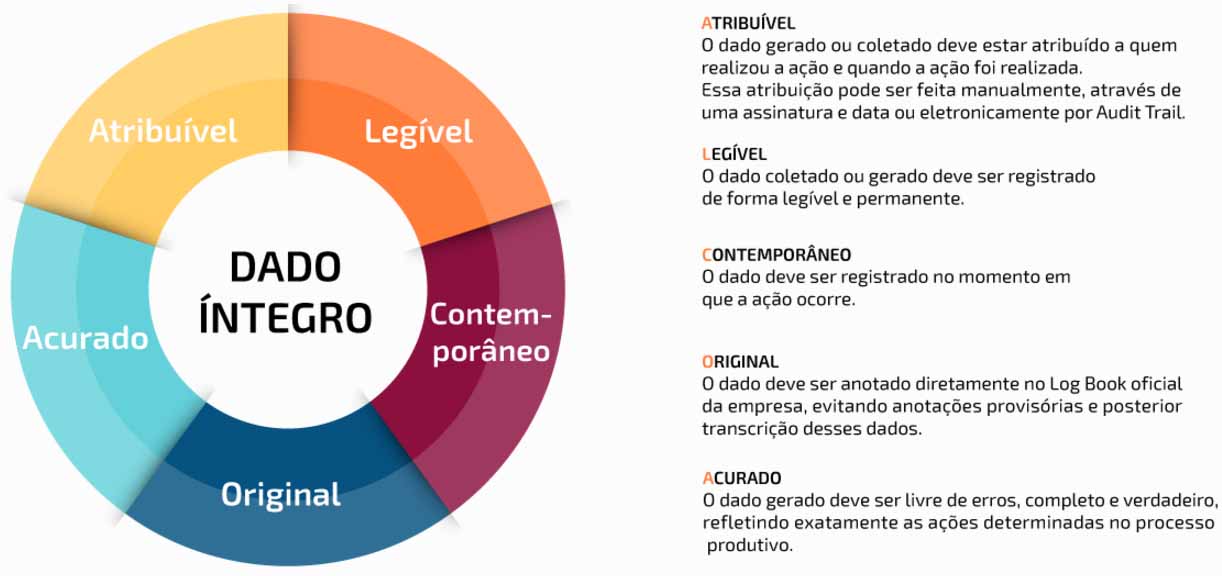
O conceito ALCOA de integridade de dados é baseado no registro e gestão acurados, completo e consistente de um dado ou informação, em papel ou de forma eletrônica. O termo faz menção às características de Data Integrity – FDA que um dado deve conter, para ser considerado íntegro pelas agências reguladoras:
Conceito ALCOA + PIC/S
Além do conceito ALCOA definido pelo FDA, a agência PIC/S, com sede na Suíça utiliza o conceito ALCOA +, que evidencia outras características a um dado considerado íntegro, são elas:
Como o processo pode contribuir para a integridade de dados críticos
Algumas ações podem ser tomadas para incluir no processo produtivo a execução de procedimentos que contribuem com as exigências de Data Integrity das agências reguladoras. São medidas para garantir que os processos sejam definidos de forma que os dados críticos sejam gerados e protegidos contra alterações.
 Manter um relógio disponível nas áreas de atividades, evita anotações erradas de tempo. Uma ação que contribui para que o registro do dado seja Acurado.
Manter um relógio disponível nas áreas de atividades, evita anotações erradas de tempo. Uma ação que contribui para que o registro do dado seja Acurado. Controlar acesso a sistemas informatizados prioriza a rastreabilidade do dado e garante que ele seja Atribuível.
Controlar acesso a sistemas informatizados prioriza a rastreabilidade do dado e garante que ele seja Atribuível. Facilitar o acesso do operador aos documentos referentes às atividades que ele exerce, evita o registro de dados posterior à ação, determinando que o dado não é Contemporâneo.
Facilitar o acesso do operador aos documentos referentes às atividades que ele exerce, evita o registro de dados posterior à ação, determinando que o dado não é Contemporâneo. Evitar transcrição de dados, utilizando impressoras diretamente conectadas em equipamentos garante que o dado seja Original.
Evitar transcrição de dados, utilizando impressoras diretamente conectadas em equipamentos garante que o dado seja Original. Controlar formulários sem preenchimento é uma forma de minimizar os riscos de preenchimento errado e evitar que o dado não seja Acurado.
Controlar formulários sem preenchimento é uma forma de minimizar os riscos de preenchimento errado e evitar que o dado não seja Acurado. Facilitar o acesso aos dados brutos, pelos responsáveis pela revisão dos dados, minimizam os riscos de indicação de não-conformidades pelas agências reguladoras.
Facilitar o acesso aos dados brutos, pelos responsáveis pela revisão dos dados, minimizam os riscos de indicação de não-conformidades pelas agências reguladoras.As Agências Reguladoras realizam auditorias focadas em Integridade de Dados e estão comprometidas com o acompanhamento dos casos de fraude em todo o mundo.
Os órgãos compartilham entre si os casos de não-conformidade para ter um panorama mundial de como o tema tem sido tratado pela indústria.

Para as indústrias é essencial o investimento em treinamento dos funcionários para lidar com dados BPx relevantes e criar uma cultura dentro da empresa de atenção aos procedimentos que envolvem a integridade de dados críticos, de forma que os colaboradores sintam-se responsáveis pela integridade dos dados gerados em sua área, etapa de produção ou análise.
Clique aqui e assista ao vídeo sobre o assunto.
REFERÊNCIAS:
EMA: Questions and answers: Good manufacturing practice – Data Integrity Section
FDA: FDA Data Integrity Guidance
MHRA: MHRA Data Integrity Definitions and Guidance
PIC/S: PIC/S Guidance
WHO: WHO Guidance






Parabéns aos autores deste artigo. Este tema é de suma importância para o atendimento das normas de BP.