Monitoramento microbiológico em ambientes farmacêuticos críticos como ferramenta de manutenção da qualidade
Um dos grandes desafios dos “novos tempos” é, sem dúvida, atingir o topo da pirâmide da qualidade. E, o outro grande desafio é manter constante o nível de qualidade alcançado. Sem esta, um produto farmacêutico, cosmético, saneante, produto para a saúde ou um alimento, terá grande dificuldade em preencher de forma estável, um espaço no mercado atual. Para tanto, grandes esforços são necessários do ponto de vista gerencial, tecnológico e financeiro. Mas em contra partida, a realidade mundial imprime a necessidade de produzir mais e melhor, com um custo o mais reduzido possível. Podemos considerar isto, como uma equação matemática, que muitas vezes é de difícil resolução.
Os produtos podem ser considerados de qualidade, quando cumprem com os atributos de qualidade descritos em Normas ou Compêndios oficiais. E, em se tratando de medicamentos, por exemplo, são requisitos: químicos, físicos, microbiológicos, terapêuticos e toxicológicos (8).
Portanto, o ponto primordial é uma redução de custos, porém sem a perda da qualidade desejada, e exigida pelos Órgãos Sanitários. Neste panorama, um alto nível de gerenciamento dos recursos disponíveis, e um assessoramento técnico eficiente, são decisórios para o sucesso.
A implantação de um sistema de gestão da qualidade, e o atendimento das Normas de boas práticas de fabricação e controle, sustenta a qualidade do que se produz, e desencadeia uma séria de ações, que de acordo com cada empresa, pode significar redução de custos e aumento de competitividade. Ou seja, investir com sabedoria permite economia, pois reprocessos, devoluções, transtornos gerais causados pela qualidade duvidosa no produto final, acarretam em desgastes e custos elevados para o fabricante.
Neste sentido, as ações preventivas à contaminação microbiana nos produtos e ambientes críticos, são fundamentais para a segurança do usuário ou consumidor, da empresa e de seus colaboradores, além de exigidas pelas normas de boas práticas da ANVISA e do MAPA.
Principais fontes de contaminação e seus indicadores
Os ambientes ou áreas consideradas críticas, são aquelas onde produtos, matérias-primas, embalagens primárias e/ou colaboradores, possuem risco de contaminação pelo contato direto com o ambiente, com agentes químicos e biológicos, micro-organismos dispersos nas superfícies ou no ar, durante sua manipulação e preparo.
As Normas de boas práticas de fabricação (3), manipulação ou de fracionamento de insumos farmacêuticos, por exemplo, apresentam um considerável número de exigências fundamentais para a redução dos riscos de contaminação microbiológica, e também físico-química dos produtos. São requisitos clássicos como a obrigatoriedade do uso de materiais sanitários e com acabamento sanitário (liso, lavável, não absorvente e/ou adsorvente e resistente aos agentes destinados à desinfecção ou sanitização das superfícies). Além disto, não é permitida a livre troca de ar entre ambientes considerados “sujos” com aqueles considerados “limpos” ou áreas críticas. E, ainda, em muitos casos uma exaustão com filtração para a proteção do ambiente externo é requerida na extração de contaminantes do ambiente fabril.
A contaminação microbiana das áreas críticas pode ser proveniente ainda: da troca de ar entre ambientes internos; dos materiais de acondicionamento das matérias-primas e de embalagens primárias para os produtos em processo; dos equipamentos e utensílios de produção; das próprias matérias-primas; da água, do ar comprimido ou gases utilizados nos processos; dos agentes utilizados para a limpeza e sanitização das superfícies críticas; através da retenção de sujidades por um tempo suficiente para a proliferação microbiana local; e principalmente através de falhas do próprio pessoal de operação.
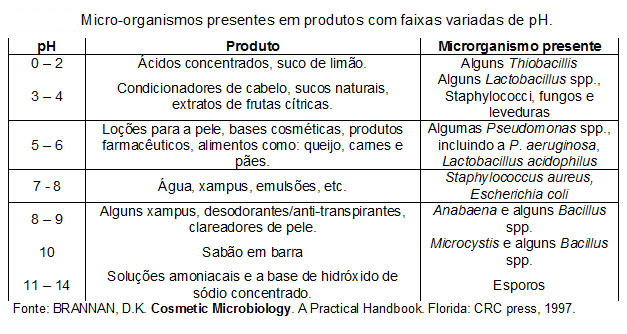
A grande diversidade de micro-organismos existentes na natureza, e a capacidade de sobrevivência em ambientes inóspitos ou em situações críticas, como a falta de nutrientes e/ou em faixas extremas de pH ou baixa umidade, permite afirmar que o estado de limpo e sanitizado, ou de esterilizado é algo relativo, e deve possuir um prazo de validade definido. A Tabela 1 apresenta alguns exemplos de micro-organismos capazes de sobreviver em faixas extremas de pH.
A Tabela 2 apresenta exemplos de micro-organismos e suas resistências frente aos agentes sanitizantes comumente utilizados nos procedimentos de contenção da proliferação microbiana, conforme a Farmacopeia Americana, capítulo nº. 1072 (8).

Neste mesmo capítulo desta farmacopeia, estão descritos pontos que sustentam a tese de que é improvável o desenvolvimento de resistência destes micro-organismos a um agente químico sanitizante. Porém, ressalta-se que alguns Gêneros já são naturalmente resistentes, como por exemplo, o Gênero Pseudomonas frente aos agentes a base de amônio quaternário. O fato é que os procedimentos de limpeza e sanitização devem considerar uma limpeza prévia adequada para reduzir os materiais aderidos às superfícies, e garantir o livre acesso da solução sanitizante ao seu alvo. Além disto, é necessário determinar o melhor agente sanitizante em relação ao espectro de ação, baixa toxicidade, solubilidade em água, compatível com as estruturas a serem sanitizadas, dentre outras características desejadas (7). Além disto, o tempo de contato destes agentes sanitizantes com os micro-organismos é fundamental para o sucesso do procedimento. Porém, ainda outros fatores são também críticos, como: o uso da concentração correta do agente químico; o tipo de água utilizado para a diluição destes agentes; o prazo de validade após o preparo para uso; o conhecimento da biocarga predominante nos ambientes críticos através do monitoramento de rotina; o treinamento frequente do pessoal responsável pela limpeza e sanitização (1, 4, 5).
Os produtos não estéreis são de certa forma, o grupo que apresenta a maior variação na carga microbiana. Isto é devido, em parte, pelos recursos tecnológicos aplicados à sua produção, a biocarga permissiva nos ambiente e nas matérias-primas, quando comparados com o grupo dos produtos que devem apresentar esterilidade.
A natureza e a frequência dos testes de controle de qualidade conferidos aos diversos produtos e seus processos de obtenção, variam conforme as exigências legais, e também em relação ao risco identificado em cada produto, como: a susceptibilidade do produto em contaminar-se, o tipo e a natureza das matérias-primas utilizadas na sua produção (de origem natural ou sintética), os processos aplicados, a indicação de uso e via de administração, as condições de armazenagem, etc. Seguindo este racional, as empresas devem adotar um plano de contenção ou de prevenção à contaminação microbiana, que deve considerar os requisitos de qualidade exigidos para o produto final.
Na semana que vem, daremos sequência ao artigo falando sobre as estratégias para a prevenção e monitoramento da contaminação microbiana em ambientes críticos.
Bibliografia
- AMARAL, F. D. Validação de limpeza. Controle de Contaminação. Editora Nova Técnica. Ano 9, No. 96, 27-29. São Paulo, 2007.
- BRANNAN, D.K. Cosmetic Microbiology. A Practical Handbook. Florida: CRC press, 1997.
- BRASIL. Ministério da Saúde. Resolução – RDC n°17, de 16 de abril de 2010. Boas Práticas para a Fabricação e Controle de Produtos Farmacêuticos. Brasília: ANVISA, 2010.
- NICOLÓSI, M. Validação de Limpeza exige equipe multidisciplinar. Controle de Contaminação. Editora Nova Técnica. Ano 10, No. 112, 20-27. São Paulo, 2008.
- WHO. Good manufacturing practices for pharmaceutical products: main principles, Annex 5, Geneva, WHO Technical Report Series No. 961 (2011). www.who.int/
- PERRY, J.J.; STALEY, J. T. Microbiology: Dinamics & Diversity. Washington: College Publishing, 1997.
- RUSSELL A. D.; HUGO, W.B.; AYLIFFE G. A. J. Principles and pratice of desinfection, preservation and sterilization. Oxford: Blackwell Scientific, 1982.
- THE United States Pharmacopeia. 35 ed. Rockville: Mack Printing, 2012.
- ZARDO, H.; AMARAL, F.D. Contribuição do sistema AVAC na redução de riscos. Controle da Contaminação. Editora Nova Técnica. Ano 13, No. 145, p. 14-18. São Paulo, 2011.
Fernando Daniel Amaral – Farmacêutico Industrial, Mestre em Microbiologia
Consultor Técnico – www.unicasuporte.com.br
fdamaral@terra.com.br
Este artigo foi revisado em 2013 a partir da sua publicação inicial na Revista Fármacos & Medicamentos, Nº. 67 – Ano XII – Julho/Agosto/ Setembro de 2011. Editora RCN.
Foto: U.S. Food and Drug Administration




Ótimo artigo.
Parabéns.