Controle e monitoramento de processos farmacêuticos e sistemas validados
Atualmente já estamos familiarizados com as atividades de qualificação e validação associadas aos conceitos de Boas Práticas de Fabricação. Desde a Resolução, RDC nº 134, de 13 de julho de 2001, a ANVISA já apresenta Regulamentos Técnicos orientando sobre as Boas Práticas para a Fabricação de Medicamentos associada à validação de processos.
A RDC atual (RDC 17-10-2010), que dispõe sobre Boas Práticas de Fabricação, nos mostra evoluções interessantes neste período de quase 10 anos.
Um dos principais fatores que podemos citar é a remoção dos roteiros pré-definidos de inspeção que nos permitem ousar na demonstração de robustez de nossos processos, resultado da eficiência de um gerenciamento eficiente do sistema de Garantia da Qualidade.
Para direcionar o programa de monitoramento de processos, podemos citar 2 exemplos mencionados na RDC 17:
– Embasamento do monitoramento em revisões periódicas de cada processo, conhecida como RPP-revisão periódica de produto;
-Definição de situação de qualificação/ validação, com periodicidade definida, obrigatoriamente descrita nos documentos relevantes da empresa, como o manual da qualidade ou plano mestre de validação.
É fato que os processos apresentados nas indústrias estão atualmente validados. O conceito de que validar é evidenciar o momento, representando um momento específico está difundido.
O foco agora esta voltado para: como avaliar criticamente os registros obtidos através do monitoramento dos processos; como definir o momento exato de interferir para retornar ou manter uma condição de processo controlado; como avaliar as variáveis envolvidas e definir qual apresenta maior impacto e/ou gera melhores resultados.
Para nos auxiliar, temos os conceitos do guia para indústria – Q10, do ICH, que trata entre outros do monitoramento de Sistemas de Qualidade Farmacêuticos, disponível para consulta desde 2007.
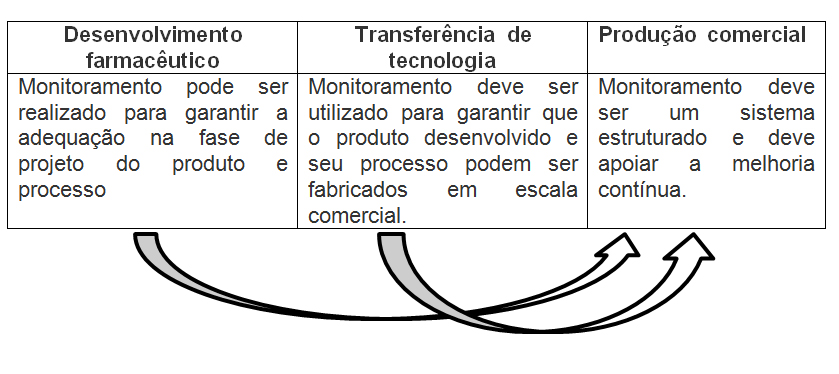
Tendo em vista que o monitoramento deve ser uma constante em nosso sistema de gestão, por todo o ciclo de vida do produto, podemos reunir as informações destas fases iniciais para auxiliar na avaliação da melhoria contínua do processo, e utilizá-las quando o produto está na escala comercial:
Até mesmo se o ciclo de vida esta em fase final e o produto esta em fase de descontinuação o monitoramento deve ser realizado e incluir itens como estabilidade do produto e reclamações de qualidade do produto.
Há diversas ferramentas voltadas para este acompanhamento e extensamente utilizadas que continuam sendo aperfeiçoadas e, por vezes, associadas na tentativa de encontrar o melhor caminho para monitorar os processos e orientar a sua melhoria.
Exemplo1: análise de riscos que associa a probabilidade de ocorrência com a sua severidade, utilizada em conjunto com um CAPA (ações corretivas e preventivas).
Exemplo 2: Associação da FMEA (Modo de falha e análise de efeitos) a mapas de processos e matriz de causa e efeito, e ainda ao impacto direto desta ação para o usuário.
Este último foi publicado recentemente e o citarei aqui de forma bastante resumida, apenas com o intuito de reiterar que a associação de informações e ferramentas podem ajudar na diretriz das ações a serem tomadas.
Esta sugestão é interessante, pois avaliar os processos como “entradas” e “saídas”, pode facilitar a visualização das causas de maior variação para cada processo.
Exemplo: embalagem automática
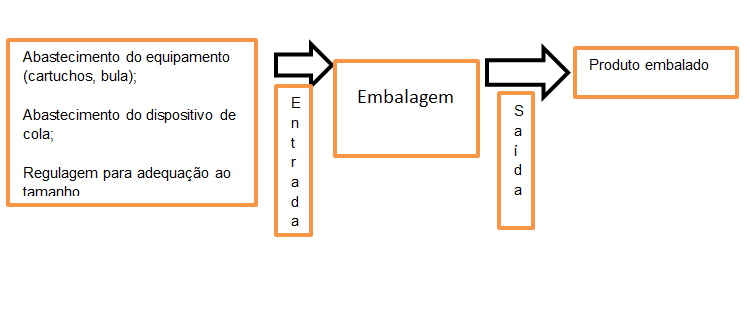 Além dos fatores inerentes ao processo, não podemos deixar de considerar em nossos monitoramentos os fatores externos que impactam no Sistema de Qualidade Farmacêutica e que gerencialmente precisam ser considerados:
Além dos fatores inerentes ao processo, não podemos deixar de considerar em nossos monitoramentos os fatores externos que impactam no Sistema de Qualidade Farmacêutica e que gerencialmente precisam ser considerados:
(a) Novas normas regulatórias de orientação;
(b) Inovações em processos;
(c) Alterações no ambiente de negócios e objetivos;
(d) Mudanças na propriedade do produto.
O resultado esperado do monitoramento de um sistema de qualidade farmacêutica envolve a avaliação de fatores internos e externos:
(a) Melhorias no sistema de qualidade farmacêutica e processos relacionados;
(b) Alocação ou realocação de recursos e / ou treinamento de pessoal;
(c) Revisão da política e objetivos de qualidade;
(d) Comunicação efetiva e periódica, com esferas mais altas da empresa, sobre as ações resultantes de monitoramento.
O importante é que as ações de melhoria implantadas possam estar sempre vinculadas a apenas “possibilidade” de desvios de processo e que possamos antecipá-los, cada vez mais tratando sempre as modificações previstas como ações preventivas e ou melhorias de processo para manter o processo sob controle.
Referências
ANVISA- Resolução da Diretoria Colegiada – RDC 17-Regulamento Técnico de Boas Práticas de Fabricação- 16 de abril de 2010.
ICH-Harmonized Tripartite Guideline-Q10-Pharmaceutical Quality System-December 2008
Quality Progress – ASQ – FAIL Safe FMEA – Janeiro de 2012.
Rosângela Peixoto Stavridis, Gerente de Projetos de Validação da Telstar.
Artigo publicado originalmente na Revista Controle de Contaminação